تتكون أى محطة تحلية بنظام RO من ثلاث أقسام رئيسية هى :
3.المعالجة النهائية للماء المنتج
وسوف نقوم بتناول كل قسم من هذه الأقسام بالشرح بشىء من التفصيل
أولا” : المعالجة الأولية لمياه التغذية :
ويتم خلالها معالجة مياه التغذية قبل دخولها على المحطة عن طريق حقن كيماويات بغرض تقليل مخاطر هذه المياه على مكونات المحطة ، وتتم بالمركبات الآتى بيانها بعد :
1. حقن حمض بمحطات التناضح العكسي :
يتم إستخدام حمض الكبريتيك لهذا الغرض على نطاق أوسع حيث أنه أسهل فى الحصول عليه كما أنه أرخص ، ونظرا” لإرتفاع تكلفة إنتاج المتر المكعب من المياه المحلاة فإن الإقتصاديات بالتحلية هو مؤثر معتبر ، ولكن ما هو الدور الذى يقوم به الحمض ؟ .
قلوية الماء قد تتكون سببا فى حدوث Scaling للأغشية مما يؤثر فى كفاءتها .. وللتخلص من هذه القلوية يتم حقن الحامض حيث :
– يقوم الحمض بإذابة جزء من قلوية الماء التى قد تكون بيكربونات ذات الصيغة ( HCO3¯ ) ، أو كربونات ذات الصيغة ( CO3¯ ¯ ) ، أو هيدروكسيدات ذات الصيغة ( OH¯ ) ، ونتيجة لذوبان جزء من هذه القلوية ينتج غاز ثانى أكسيد كربون .
( PH ، تركيز قلوية الماء Alkalinity ، تركيز ثانى أكسيد الكربون ) ، يمكن التعبير عن هذه العلاقة بالمعادلة التالية :
وهذه المعادلة تعنى ما يلى :
– أن قيمة PH ترتبط بعلاقة لوغاريتمية مع تركيز قلوية الماء ، وتركيز غاز ثانى أكسيد الكربون ، يعنى كلما قل تركيز أحدهما زاد تركيز الآخر ، يعنى عندما يقل تركيز قلوية الماء ، يزيد تركيز ثانى أكسيد الكربون ، وبالتالى تقل قيمة PH ، والعكس .
ويجب الأخذ فى الإعتبار ما يلى :
بمعنى عندما تكون قيمة 6.3 > PH يحتوى الماء على تركيزات عالية من Co2 الذى قد يتأكسد جزء منه إلى حمض الكربونيك الذى يصل بقيمة PH حتى أقل من 4.2 .
– عندما يتساوى تركيزى قلوية الماء ، ثانى أكسيد الكربون تكون قيمة PH = 6.3 ، حيث تكون قيمة الكسر alk] / [co2] = 1 ]، وتكون قيمة [ log [alk] / [ co2 = صفر ، وعندئذ تكون قيمة PH = 6.3 ، مما يعنى أن الماء يكون تام التعادل عند قيمة PH = 6.3 ، ولكن يفضل شربها عندما تزيد قلويتها قليلا” ، يعنى حول الرقم ( 7 ) ويمكن الوصول إلى هذه القيمة عندما يكون تركيز القلوية = 5 مرات تركيز ثانى أكسيد الكربون .
– عندما تكون قيمة 8.3 > PH تكون قلوية الماء ( Alkalinity ) عبارة عن البيكربونات ولهذا يتم فى الأنظمة المطلوب منها إنتاج مياه ذات أملاح منخفضة جدا يتم حقن قاعدة قبل دخول وحدة RO لرفع قيمة PH حيث أن Salt Rejection ( حجز الأملاح ) يكون أفضل فى PH الأعلى ولكن مع الحذر الشديد ألا تصل قيمة PH إلى 8.3 خوفا من حدوث ترسبات من أملاح أحد مكوناتها هى الكربونات .
– عندما تكون قيمة 8.3 ≤ PH تكون قلوية الماء هى الكربونات .
يعنى حقن الحمض يجب أن يتم بشكل مدروس ومحدد بضوابط حيث أن نقص حقنه يؤدى إلى مشكلة تكون Scaling وزيادة حقنه يؤدى إلى مشاكل ، من أهمها :
وسيتم إن شاء الله بتوسع الحديث عن موضوع التآكل ، وأنواعه ، وطرق مقاومته فى حينه .
– كما أن من مشاكل زيادة جرعة حقن الحامض هو زيادة تركيز الشق الخاص به فى الماء ، يعنى زيادة جرعة حقن حامض الكبريتيك يزيد من تركيز أيون الكبريتات فى الماء ، وزيادة جرعة حقن حامض الهيدروكلوريك يزيد من تركيز أيونات الكلوريدات بالماء ، وكلاهما ( الكبريتات والكلوريدات قد تكون هى نفسها سببا” فى حدوث Scaling .
– كما أن من مشاكل زيادة جرعة حقن الحامض هو إنطلاق غاز ثانى أكسيدالكربون بكميات كبيرة تتناسب مع معدلات حقن الحامض مما يجعل ماء التغذية حامضيا بشكل مبالغ فيه و لإعادة الماء المنتج إلى تعادله يلزم حقن قلوى بكميات كبيرة تتناسب مع كمية غاز ثانى أكسيد الكربون المنطلق ، أو إستخدام Degasifier على نطاق أوسع مما يزيد تكلفة التشغيل .
دى كانت أول مهمة للحامض فى المعالجة الأولية لمياه التغذية .
ويمكن إعتبار ما سيتم طرحه فى هذا الجزء يقع ضمن
تصميم نظام الحقن الكيميائى بالمحطة
هناك محدد لحقن الحامض لهذا الغرض .. يختلف بإختلاف نوع مياه التغذية كما يلى :
– فإذا كانت مياه التغذية Brackish Water فإن هذا المحدد يطلق عليه Langelier Saturation Index والذى يختصر إلى ( LSI ) .
– أما إذا كانت Sea Water فإن هذا المحدد يطلق عليه Stiff & Davis Stability Index والذى يختصر إلى ( S &DSI ) .
كلاهما إذا كانت قيمتهما أصغر من الصفر فلن يكون هناك تخوف من ترسب كربونات الكالسيوم ، والآن ننتقل إلى طريقة حساب كليهما .
أما إذا كانت على هيئة كربونات نضرب × 1.666 .
طريقة حساب Langelier Saturation Index بمحطات المياه :
هو عبارة عن PH للمياه الشديدة التركيز
(Concentrated ( Brine PH هو عبارة ( PHs ) –
لمياه (Concentrated ( Brine عندما يحدث لها تشبع بملح كربونات الكالسيوم ، وتتم الحسابات كالتالى :
أولا” : حساب قيمة PH c :
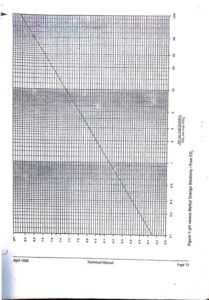
كمحدد لحقن Acid لكى يقوم بدور Anti Scalent خاص بكربوبونات الكالسيوم .. ننتقل إلى طريقة حساب المكون الثانى للعلاقة :
– نحسب Pca كدالة فى Ca c ، ونحسب Palk كدالة فى alk c الذى سبق حسابهما .. وذلك عن طريق Chart الخاص بهما
– نحسب قيمة C كدالة فى TDS c ، Temp c مع فرض أن قيمة حرارة المياه الشديدة التركيز = درجة حرارة مياه التغذية وذلك أيضا” من نفس Chart ( المرفق التالى ) .

– إذا كانت LSI c أصغرمن الصفر فلن يكون هناك تخوف من ترسب كربونات الكالسيوم .
– أما إذا كانت أكبر من الصفر فسوف يحدث Scaling من كربونات الكالسيوم ، ولضبط قيمتها يمكن إتباع مايلى :
1. خفض قيمة Recovery .
2. إختزال تركيز أيونات الكالسيوم فى مياه التغذية بإستعمال Resin .
3. حقن الحامض ،
ولإعادة الحسابات بعد إضافة الحامض يمكن إستخدام المعادلات الآتية حسب نوع الحامض المستخدم :
(Alk ac ) / (Co2 ac ) = (Alk f – 1.02 x ) / (Co2 f + 0.9 x )
حيث أن x هى جرعة حقن حمض الكبريتيك .
أما إذا تم إستخدام حامض الهيدروكلوريك نستخدم هذه العلاقة :
حيث أن y هى جرعة حقن حمض الهيدروكلوريك .
ac هى إختصار لكلمة acidified يعنى القيمة بعد إضافة الحامض .
Stiff & Davis Stability Index ( S& DSI )-
– نفس الطريقة السابقة ، ويتم الحصول على قيمتها من نفس الرسم البيان الخاص به .
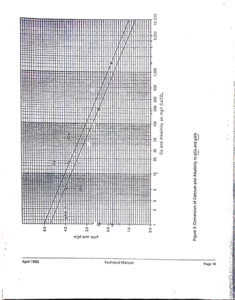
ويتبقى لدينا حساب K الثابت الواقع ضمن نفس العلاقة :
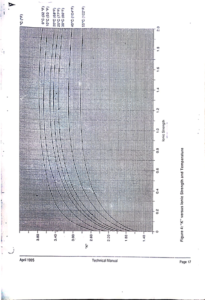
ثالثا” حساب K :
وجد أن هذا الثابت ( K ) يعتمد على مايلى :
2.Temp .
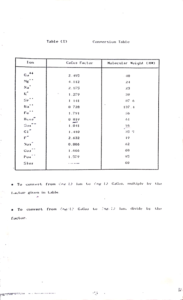
حيث m¯ تركيز الأيونات السبعة التى تتواجد معظم الأملاح على صورها وهى :
أربعة أيونات موجبة ( كاتيونات ) وهى الصوديوم ( Na+) ، البوتاسيوم ( K+ ) ( ، الكالسيوم ( Ca ++ ) والماغنسيوم ( Mg++) .
( HCO3¯) ،
Molarity =C ion( mg/l) / (1000×MW)
S&D SI = PHc – PHs
3. حقن الحامض
وبهذا نكون قد إنتهينا من ثانى وظيفة من وظائف الحمض وهى أنه يعمل كـ Anti Scalant لمنع ترسب ملح كربونات الكالسيوم وننتقل الآن إلى شرح باقى وظائف الحمض
– إيقاف تكوين Fouling الذى تسببه العناصر الإنتقالية مثل الحديد والمنجنيز :
يجب العلم أن العناصر الإنتقالية ( Transition Metals ) هى عناصر يمكن أن يكون لها أكثر من تكافؤ وقد سميت بهذا الإسم لأنها تنتقل من تكافؤ إلى آخر إذا توفرت شروط حدوث ذلك .
يعنى فى الصورة (++ Fe ) ، ( ++Mn ).
وهذين الأخيرين نتيجة وجودهما فى الماء فإنها تكون هيدروكسيد الحديديك والذى يطلق عليه صدأ الحديد ، وهيدروكسيد المنجنيز اللذين يقومان بعمل Fouling على أسطع الأغشية طبقا” للمعادلات التالية :
Mn++ → Mn+++→Mn ( OH )3