عسر الماء
ما هو العسر؟
ما أسباب العسر؟
ما هى أنواع العسر؟
ما هى أضرار العسر؟
درجات العسر.
كيف يتم تحليل العسر؟ وما هو الغرض من التحليل؟
كيفية إزالة العسر.
ما هو عسر الماء ؟
عسر الماء (أو قساوة الماء) هو مقياس لإمكانية ترسيب الصابون (تكسير رغوة الصابون).
وما يحدث كيميائياً أن أملاح الكالسيوم والمغنيسيوم تتفاعل مع الصوديوم الموجود فى الصابون مكونة صابوناً معدنياً لا يذوب فى الماء وهذا هو سبب عدم تكون رغوة الصابون مع المياه العسرة.
ما أسباب عسر الماء؟
يرجع العسر لتواجد أيونات الكالسيوم والماغنسيوم فى الغالب وقد يرجع لوجود عناصر أخرى بتركيزات أكبر من المعتاد بسبب التلوث مثلاً ومن الممكن ادخالها فى حساب العسر الكلى للماء بعد تعيين نسبة كل عنصر (مثلAl,Fe,Ba,Sr, Mn ) وهى عناصر polyvalent Cations.
ويبقى الكالسيوم والمغنسيوم اللاعبان الأكبران فى إحداث العسر للتأثير الضعيف الذى تلعبه بقية العناصر السابقة ، لذا تم الإتفاق على أن العسر الكلى هو مجموع تركيزى الكالسيوم والمغنيسوم.
والمياه السطحية والجوفية يتراوح الكالسيوم من العشرات إلى مئات الجزء فى المليون بينما الماغنسيوم من 1 إلى العشرات جزء فى المليون.
والماغنيسوم أقل من الكالسيوم فى الوفرة لقلة تواجده بالقشرة الأرضية بالمقارنة بالكالسيوم:
Ca: Mg ratio ≈ 2-4 (common
Ca: Mg ratio up to 10 (Sometimes
ما هى أنواع عسر المياه؟
1- العسر المؤقت temporary hardness (عسر الكربونات):
يرجع نتيجة أملاح بيكربونات الماغنسيوم والكالسيوم الذائبة فى الماء، وسمى مؤقتاً لأننا نستطيع التخلص منه بغليان الماء أو إضافة أى softener مثل هيدروكسيد الكالسيوم.
Ca (HCO3) g Heatg Ca CO3i + CO2h + H2O
Ca CO3 D Ca+2 +2HCO3
Mg (HCO3) g Heatg Mg CO3i + CO2h + H2O
Mg CO3 D Ca+2 +2HCO3
ونرى أنه مع التسخين يقل ذوبان ثانى أوكسيد الكربون فى الماء وتترسب الكربونات على صورة راسب أبيض.
وإذا لم يتم إزالة الكربونات المترسبة وانخفضت درجة حرارة الماء فهناك امكانية لذوبان ثانى أوكسيد الكربون مرة اخرى فى الماء ليتكون البيكربونات من جديد وبالتالى يرجع العسر.
كما قلنا أنه يمكننا التخلص من العسر بإضافة softener مثل هيدروكسيد الكالسيوم.
Ca (HCO3) + Ca (OH) 2 g 2Ca CO3i + 2H2O
[Thomas Clark in 1841]- [Lime-soda ash treatment]
2- العسر الدائم permanent hardness:
يرجع نتيجة أملاح كبريتات أو كلوريدات أوسيليكات الكالسيوم والماغنسيوم الذائبة فى الماء، وسُمى “دائم” لأننا لا نستطيع التخلص منه بتسخين الماء, بل أن التسخين يزيد من ذوبانية هذه الأملاح فى الماء، ويمكن التخلص من هذا النوع بالمعالجة الكيميائية بإضافة softener مثل كربونات الصوديوم (صودا الغسيل) أو استخدام تقنية الion exchange column (resin).
CaSO4 + Na2CO3g Na2SO4 (Soluble) + CaCO3i
ما هى أهم أسباب تواجد أيونات الكالسيوم والمغنسيوم فى الماء؟
1- تحلل الCalcium & magnesium (alumino-silicates .
2- ذوبان الحجر الجيرى limestone وmagnesium limestone و gypsum وmagnesite وغيره من المعادن فى الماء.
3- معالجة مياه الشرب خلال:
– De-acidification of underground water by Ca (OH) 2
– Addition of CaO, CO2 to low mineralized water
ما هى أضرار عسر المياة؟
الماء العسر غير ضار بالصحة ولكن أضراره تبدأ من عدم مقدرته على تشكيل رغوة عند استخدامه مع الصابون أو معجون الأسنان مما يسبب زيادة فى استهلاك الصابون وقد تنتهى أضراره بمشاكل خطيرة فى البيئات الصناعية!
من أضرار المياه العسرة فى البيئات الصناعية:
1- فى الغلايات والمواسير:
ترسب أملاح الكالسيوم والماغنسيوم بالحرارة وزيادة تركيزها فيقل التوصيل الحرارى فى مختلف الأوعية الحرارية ويصعب وصول الحرارة إلى السائل المسخن وبالتالى فقد وزيادة فى استهلاك الوقود، كما ينتج عن ذلك انفجار الغلايات نتيجة لتكون طبقات عازلة تمنع التبريد فترتفع درجة الحرارة بشكل خطير أو بسبب انسداد مواسير الغلاية إلى جانب مشاكل الصدأ وتآكل المعادن.
2- فى صناعة الغزل والنسيج:
عند معالجة الألياف النيسجية بالصابون الصوديومى فإن الأملاح التى تسبب العسر تتفاعل مع الصابون لتكون صابون كلسي غير ذائب فى الماء ويترسب على الأقمشة والخيوط بشكل غير منتظم وبالتالى يساعد على جذب جزيئات الأتربة ، كما يؤدى إلى صباغة غير منتظمة بسبب مقاومة دخول جزيئات الصبغة فى الأماكن المترسبة عليها.
ووجود جزيئات الكالسيوم والمغنيسوم فى الماء يسبب تراجع كبير فى هجرة وانتشار الصبغة عند صباغة الألياف السليلوزية وهذا يؤثر على ثبات الصبغة.
ملاحظات:
- مواصفة العسر فى الsoft water يجب أن لا تزيد على 2ppm.
- مواصفة العسر فى الdemi- water يجب أن تكون بين (0 – 0.5 ppm).
- إذا زاد تركيز الكالسيوم عن 500 جزء فى المليون يعطى طعم للمياه غير مستساغ.
- الماغنسيوم يعطى طعم مُر (Bitter) إذا زاد عن 170 جزء فى المليون خاصةً إذا كان مع الكلورايد والسلفات.
- مياه الشرب المثالية تحتوى على:
ماغنسيوم بين 20 – 30 جزء فى المليون.
كالسيوم بين 40 – 80 جزء فى المليون.
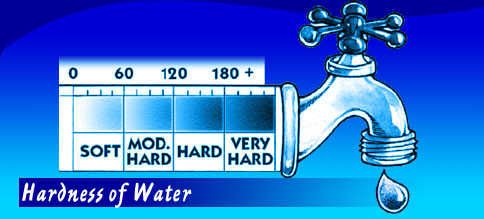
درجات عسر المياة (القساوة):
درجة العسر هو مجموع العسر المؤقت والدائم.
وله مقاييس تختلف من دولة لأخرى فهناك مقياس إنجليزى وألمانى وفرنسي وأمريكى… إلخ ويقاس عادةً بال mg/L وتساوى واحد جزء فى المليون (ppm)، وتُنسب إلى كربونات الكالسيوم CaCO3 ومن النادر أن تنسب إلى أوكسيد الكالسيوم CaO.
يتم أيضاً التعبير عن العسر الكلى بالوحدة mmol/l وتحويل جزء فى المليون إلى هذه الوحدة مذكورة فى الحسابات الخاصة بتجربة العسر (كما سيأتى).
Description | Hardness (ppm) (mg/l) as CaCO3 |
Very soft ماء يسر جداً | 90 > |
soft ماء يسر | 90 – 180 |
Medium hard ماء نصف عسر (أو متوسط القساوة) | 180 – 270 |
Hard ماء عسر(قاسي) | 270 – 450 |
| Very hard ماء عسر جداً | 450 < |
| Description | Hardness (ppm) (mg/l) as CaCO3 |
| soft | 60 > |
| Moderately soft | 61 – 120 |
| Hard | 121 – 180 |
| Very hard | 180 < |
| Description | Hardness (ppm) (mg/l) as CaCO3 |
| Very soft ماء يسر جداً | 15 > |
| soft ماء يسر | 15 – 50 |
| Medium hard ماء نصف عسر (أو متوسط القساوة) | 50 – 100 |
| Hard ماء عسر(قاسي) | 100 – 200 |
| Very hard ماء عسر جداً | 200 < |
كيف يتم تحليل عسر المياه؟ وما هو الغرض من التحليل؟
Total hardness
(ASTM D1126) or (Standard method 2340 C)
فكرة التحليل:
يتم التحليل باستخدام طريقة المعايرة من نوع ال(Complexing titration) ضد الEDTA ، وفيها يتم وضع كشاف مناسب فى العينة ليتحد أولاً بالكالسيوم والمغنيسيوم، وعند إضافة الEDTA من السحاحة تبدأ فى الإتحاد مع الكالسيوم والمغنسيوم بدلاً من ذرتى الهيدروجين وتترك الكشاف حراً ليظهر لونه الأزرق السماوى ويكون ذلك عند نقطة النهاية (End point).
تفاصيل التجربة:
ما هى الEDTA؟
Ethylene diamine tetra-acetic acid
وهذا المركب من أشهر المركبات التى تتحد بالmetals لتكون متراكبات complexes.
وعادةًَ ما يستخدم الdi-sodium salt فى هذه التجربة:
Disodium Ethylene diamine tetra-acetic acid
ويتحد الكالسيوم والمغنسيوم مع الEDTA ليكون المتراكب التالى:
ويتم عمل تركيزات من الEDTA تبعاً للتركيزات المتوقعة للعينة:
0.001Molar for low hardness
0.01Molar for high hardness
ونلاحظ أنه يتم تحضير الEDTA بالمولار وليس بالنورمال لصعوبة معرفة الvalency لعدم معرفة كم يفقد المركب من أيون الهيدروجين؟
Morality = (wt/mwt) x 1000
Normality = (wt/eqwt) x 1000
(Where eqwt = mwt/ valency)
ما هو الكشافindicator ؟
Erio-chrome black-T (= Erio-T dye
[1-(1-hydroxy-2-naphthylazo)-6-nitro-2-naphthol-4-sulfonic acid]
ألوان الكشاف تعتمد على درجة الpH للمحلول:
| Red | < 6 | pH |
| Blue | 7- 11 | pH |
| Yellow or orange | >12 | pH |
يتم إجراء التجربة عند pH = 10 + 0.1 لمياه الغلايات وذلك بإستخدام محلول منظم buffer كما سيأتى ، ولذلك سيكون لون الكشاف فى المحلول أزرق ، ولكن اتحاده فى بداية الأمر بالكالسيوم والمغنيسيوم سيكون لونه أحمر خمرىred-wine وهو مركب أكثر ثباتاً من الكشاف وهو حر.
(Ca2+ or Mg2+) + Ind. Ca- Ind + Mg- Ind
(More stable than reactant)
وعند انزال الEDTA أوNa2EDTA من السحاحة ستتحد بالكالسيوم ثم الماغنسيوم ليكون المركب الناتج أقوى من اتحاد مركب الكشاف بهما وتترك الكشاف Free شيئاً فشيئاً ويمر باللون البنفسجى حتى يظهر لونه الأزرق كما سبق.
والشكل التالى يوضح لون الكشاف قبل نقطة النهاية:
(أحمر خمرى لو كان العسر قوى ويتجه يميناً كلما قل العسر سواء فى العينة الأصلية أو مع إضافة الEDTA ويمر باللون البنفسجي حتى يصل إلى نقطة النهاية عند اللون الأزرق)
والشكل التالى يوضح لون نقطة النهاية (اللون الأزرق وهو لون الكشاف الحر):
يتم إضافة المعوق inhibitor لمياه الغلايات التى تحتوى على الفوسفات التى تسبب تداخل مع أيونات الكالسيوم والمغنسيوم بسبب اتحادها بالEDTA أيضاً.
التركيب الكيميائى للمعوق هو الSodium sulphide (Na2S) والذى يتحد بأيون الفوسفات ليكون Sodium di-phosphate (Na2PO4).
ما هو الBuffer 10 ؟ وما وظيفته فى التجربة؟
Buffer (pH= 10) = weak base + conjugated acid
= NH4OH (or NH3) + NH4Cl
تفاعل الEDTA مع أيونات الكالسيوم والمغنيسيوم تفاعل عكسي:
Ca2+ + EDTA D CaEDTA + nH+
Mg+2 + EDTA D MgEDTA + nH+
نلاحظ أن تكون أيونات الهيدروجين يزيد من حامضية المحلول.
وظيفة الBuffer:
التفاعل مع أيونات الهيدروجين المتكونة وبالتالى التخلص من الحامضية الناتجة بجانب الإسراع من عملية التفاعل (إلى الإتجاه الأيمن) ومنع التفاعل العكسي وبالتالى يعطى Sharp end point.
NH4Cl NH4+ + Cl–
NH4OH NH4+ + OH–
OH– + H+ H2O
ماذا كان سيحدث لو وضعنا قاعدة قوية بدلاً من الBuffer؟
ستتفاعل مع أيون الكالسيوم والمغنيسيوم وتترسب على هيئة هيدروكسيد.
Ca2+ + OH– Ca (OH) 2$
Mg2+ + OH– Mg (OH) 2$
تفاصيل التجربة:
أولاً:تحضير المحاليل:
1- تحضير صودا كاوية لكى نستخدمها فى تحضير الEDTA:
Sodium Hydroxide Solution (50 g/L)—Dissolve 50 g of sodium hydroxide in water and dilute to 1 L.
2- تحضير محلول الكشاف وهو Erio chrome black-T أو اختصاراً (EBT):
Dissolve 0.5 g of E-Chrome Black T in 50 ml of diethanolamine or triethanolamine. Store the solution in a dark-colored bottle. This solution has a storage life of several months.
أو تحضير البودرمن الكشاف كالتالى:
Grind 0.5 g of E-Chrome Black T with 100 g of powdered sodium chloride. Use a dark-colored bottle for storage. The powder has a storage life of at least 1 year.
Note:[(Erio chrome black –T) = Sodium salt of 1-(1-hydroxy-2-naphthylazo) -5-nitro-2-naphthol-4-sulfonic acid]
3- تحضير البفر (المحلول المنظم):
1) Dissolve 16.9 g ammonium chloride (NH4Cl) in 143 ml conc. ammonium hydroxide (NH4OH). Add 1.25 g magnesium salt of EDTA (available commercially) and dilute to 250 ml with distilled water.
2) If the magnesium salt of EDTA is unavailable, dissolve 1.179 g disodium salt of ethylene diaminetetraacetic acid dihydrate (analytical reagent grade) and 780 mg magnesium sulfate (MgSO4.7H2O) or 644 mg magnesium chloride (MgCl2.6H2O) in 50 ml distilled water. Add this solution to 16.9 g NH4Cl and 143 ml conc. NH4OH with mixing and dilute to 250 ml with distilled water. To attain the highest accuracy, adjust to exact equivalence through appropriate addition of a small amount of EDTA or MgSO4 or MgCl2.
Store Solution (1) or (2) in a plastic or borosilicate glass container for no longer than 1 month.
4- تحضير الNa2H2EDTA أوDisodium Ethylenediamine Tetraacetate
- A) -01 molar Na2H2EDTA: Weigh 3.723 g of disodium
Ethylene diamine tetraacetate dihydrate in 800 ml, Adjust the pH of the solution to 10.5 with NaOH solution (50 g/L) then complete to 1000 ml standardize # Calcium standard solution (1 ml of EDTA = 1.00 mg CaCO3).
- B) -001 molar for low hardness: preparation from 0.01 molar using [M.V = M’.V’ equation].
5- تحضير محلول كالسيوم قياسى لعمل standardization للEDTA:
Dissolve 1.0 g of anhydrous CaCO3 in 1000 ml.
So that: Molarity of CaCO3 = wt (gm) x 1000/ (mwt x volume ml)
= 1 x 1000 / (100 x 1000) = 0.01 molar
Where mwt of CaCO3 = 100.09 ≈ 100
So, (M.V) EDTA = (M.V) CaCO3
If we take 10 ml of CaCO3 standard solution:
M EDTA = 0.01 x 10/ ml added (EDTA)
من الحجم المضاف من الEDTA من السحاحة يتم قياس المولارتى الحقيقية للEDTA.
ويتم عمل Standardization لمحلول الEDTA كل شهر.
6- تحضير المعوق Na2S:
Dissolve 5.0 g sodium sulfide nonahydrate (Na2S.9H2O) or 3.7 g Na2S.5H2O in 100 ml distilled water. Exclude air with a tightly fitting rubber stopper. This inhibitor deteriorates through air oxidation
تفاصيل وملاحظات على تحضير محلول كربونات الكالسيوم القياسى:
Weigh 1.000 g anhydrous CaCO3 powder (primary standard or special reagent low in heavy metals, alkalis, and magnesium) into a 500-mL Erlenmeyer flask. Place a funnel in the flask neck and add, a little at a time, 1 + 1 HCl until all CaCO3 has dissolved. Add 200 ml distilled water and boil for a few minutes to expel CO2. Cool, add a few drops of methyl red indicator, and adjust to the intermediate orange color by adding 3N NH4OH or 1 + 1 HCl, as required. Transfer quantitatively and dilute to 1000 ml with distilled water.
ثانياً:خطوات التجربة:
1- EDTA in burette (0.01M or 0.001M) or 0.02 M, 0.002 M.
2- 100 ml sample + 2ml buffer (pH =10) + Erio-T + inhibitor.
3- Titrate to blue color (end point).
ثالثاً:الحسابات (Calculations):
(M x V) as CaCO3 = (M x V.)EDTA
(Wt/Mwt x 1000) x V = (M.V.) EDTA
Wt as CaCO3 = N EDTA x V EDTA x [40+12 + (16×3)] / (ml sample. x 1000)
= M EDTA x VEDTA x 100/ ml sample. x 1000
Hardness (ppm as CaCO3) = Wt x 106
To convert hardness in ppm to mmol/l: Ppm = mg/l divide by 1000 gm/l divide by mwt of CaCO3 mol/l divide by 1000 gives mmol/l. |
1- for concentration between 10 ppm – 250 ppm:
Hardness (ppm as CaCO3) = (ml 0.01M EDTA x 1000) / ml sample.
(نأخذ فى المعتاد 100 مل من العينة)
2- for concentration less than 10 ppm:
Hardness (ppm as CaCO3) = (ml 0.01M EDTA x 1000) / ml sample
(نأخذ فى المعتاد500 مل من العينة)
(ملاحظات):
¥ تبرد العينة فى درجة حرارة الغرفة.
¥ لا توضع كمية كبيرة من ال Erio-Tحتى لا يتحد بجميع أيونات الكالسيوم والمغنسيوم ويتبقى جزء فيظهر لونه الأزرق فيعتقد الشخص المُحلل أنه لا يوجد عسر فى العينة.
3- Titration # EDTA
[The colour: wine red violet blue (sky blue)].
ملحوظة:
¥ فى حالة العسر العالى يظهر فعلاً اللون الأحمر الخمرى أما لوكان العسر قليل فإنه يظهر اللون البنفسجى أو المائل للزُرقة.
¥ يجب عمل المعايرة فى زمن لا يزيد عن 5 دقائق من وضع الBuffer.
(ينصح بالرجوع إلى الstandard method أو إلى الASTM لمزيد من الملاحظات)

التعليقات مغلقة.