-
كيف يتم حساب التناضح العكسي:
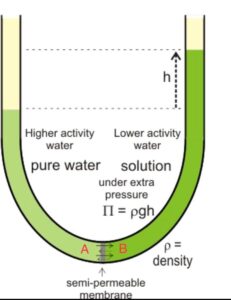
ظاهرة التناضح تحدث عندما يتدفق الماء النقي من محلول ملحي مخفف عبر غشاء إلى محلول ملحي أكثر تركيزًا.
لنفرض أن هذا الغشاء قابل لاختراق الماء وليس الملح. يتم وضع محلول ملحي في الحجرة B والماء النقي في الحجرة A.
وفقًا لقاعدة أساسية في الطبيعة، سيحاول هذا النظام الوصول إلى التوازن.
أي أنه سيحاول الوصول إلى نفس التركيز على كلا جانبي الغشاء. والطريقة الوحيدة لتحقيق التوازن هي مرور الماء من حجرة الماء النقي إلى الحجرة المحتوية على الملح لتخفيف المحلول الملحي.
هذا النقل يسبب ارتفاعًا في ارتفاع المحلول الملحي ويعبر عن هذا الارتفاع بالضغط (P = ρ g h).
سيزداد هذا الارتفاع حتى يصبح ضغط عمود الماء (المحلول الملحي) مرتفعًا بما يكفي ليوقف تدفق الماء.
نقطة التوازن لهذا الارتفاع في عمود الماء من حيث الضغط المائي ضد الغشاء تسمى “الضغط الأسموزي”
كما يظهر بالصورة
وفقًا لمعادلة فان هوف
(Van’t Hoff):
π = iCRT
π is the osmotic pressure
I is the van’t Hoff factor
C is the molar concentration of the solute in the solution
R is the universal gas constant
T is the temperature
من المعادلة السابقة يمكن حساب الضغط الأسموزي:
π = 1.12 (273 + T) ∑mi
= الوزن الجزيئي
= تركيز الأيون بالـ ppm
الخطوة الأولى لتصميم قسم RO
(الغشاء، المضخة عالية الضغط) هي حساب الضغط الأسموزي.
إذا كان التحليل المخبري كالتالي:
Ca = 410 ppm.
Mg = 1310 ppm.
Na = 10900 ppm.
K = 390 ppm.
Cl = 19700 ppm.
SO4 = 2740 ppm.
HCO3 = 180 ppm.
1- حساب التركيز بالمول/كجم:
mi = ci / (1,000 \times MWi)
Ca = مول/كجم
Mg =
Na =
K =
Cl =
SO4 =
HCO3 =
TDS = 35000 ppm
2- حساب مجموع التركيزات:
∑mi = 1.134495
3- تحديد درجة الحرارة المستخدمة في التصميم:
نفترض 25°C.
4- حساب الضغط الأسموزي:
π = 1.12 (273 + T) ∑mi
= 1.12 \times (273 + 25) \times 1.1344 = 378 psi
If the lab send you the following analysis
Ca = 410 ppm. MW=40
Mg=1310 ppm. MW=24.3
Na = 10900 ppm. MW=23
K = 390 ppm MW=39
CL= 19700 ppm. MW=35.5
SO4=2740 ppm. MW=96
HCO3 = 180 ppm MW=61
1- calculate the concentration in Mol/kg
mi = ci /(1,000 MWi)
Ca = 410 / (40 x 1000)=0.01025 m/kg
Mg=1310/ (24.3×1000)=0.053909
Na = 10900/(23×1000)=0.4739
K =390/(39×1000) =0.01
CL=19700/(35.5×1000)=0.5549
SO4= 2740/(96×1000)= 0.0285
HCO3 = 180/(61×1000)=0.00295
TDS = 35000 ppm
2- calculate
∑mi = 1.134495
3- detrime the design temperature
Assume 25 C
4- calculate the osmotic pressure
π =1.12(273+T)∑mi
1.12 (273 +25) 1.1344= 378 psi
يمكننا تقدير الضغط الأسموزي باستخدام المعادلة التالية تقريبيًا:
π = 0.0104 \times TDS = 365 psi
نقلت عن م/ محمد عبدالعال
لاستكمال باقى المقالات المرتبطة